Het arsenaal aan geneesmiddelen met antilichamen groeit. Het Gentse biotechbedrijf Ablynx heeft daar mee voor gezorgd. Heeft de geneeskunde haar magic bullets gevonden?
De Brusselse professor emeritus Raymond Hamers is op 22 augustus 2021 op 88-jarige leeftijd overleden. Hij was een pionier in het onderzoek naar nanobodies. In 1989 ontdekte hij samen met zijn echtgenote Cécile Casterman en met Serge Muyldermans het bestaan van een nieuw soort kleinere antilichamen in het bloed van een dromedaris, later ‘nanobodies’ genoemd. In 2001 leidde dat tot de oprichting van de VUB spin-off Ablynx, die onderzoek doet naar geneesmiddelen op basis van nanobodies. In dit artikel, dat verscheen in Eos (oktobernummer 2014), komt zijn bijzondere ontdekking uitgebreid aan bod.
Eind 19de eeuw ontdekte de Duitse fysioloog Emil von Behring dat hij cavia’s kon beschermen tegen difterie door de diertjes te injecteren met bloed van soortgenoten die de ziekte hadden overwonnen. Von Behring was daardoor de eerste die met een zogenoemd antiserum een dier kon wapenen tegen een welbepaalde ziekte. Voor zijn werk kreeg hij in 1901 de eerste Nobelprijs voor de Geneeskunde.
Wat Von Behring deed bij zijn cavia’s, doet sterk denken aan vaccinatie: iemand immuun maken door zijn afweersysteem bloot te stellen aan dode of verzwakte ziektekiemen. Maar de Duitser injecteerde geen difteriebacteriën. Hij had ingezien dat de cavia’s een nog onbekende ‘substantie’ in hun bloed hadden die de difteriebacteriën te lijf ging en ze vervolgens neutraliseerde.
Von Behring en zijn collega Paul Ehrlich noemden de substantie een magische Kugel (een magische kogel of magic bullet). Daarmee lanceerden ze een term die vandaag nog steeds populair is. Want wat is een magic bullet anders dan een supermedicijn dat alleen de ziekteverwekker treft en de rest van het lichaam ongemoeid laat – waardoor de behandeling met het medicijn niet één bijwerking oplevert? Een kankertherapie die geen haaruitval, misselijkheid of blijvende weefselschade veroorzaakt. Of een medicijn tegen trombose dat alleen lokaal bloedklontering tegengaat, zodat elders geen interne bloedingen optreden.
Antilichamen
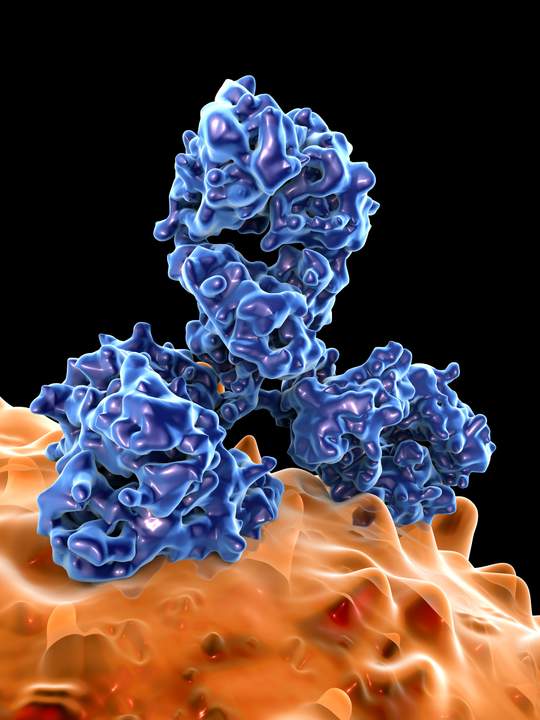
Eigenlijk beschikken we al over een natuurlijke vorm van magic bullets: de antilichamen in ons bloed die ons afweersysteem aanmaakt wanneer het een bedreiging voor onze gezondheid detecteert. Er bestaan niet minder dan tien miljoen verschillende types. Elk van die tien miljoen antilichamen heeft een specifieke werking die wordt bepaald door haar Y-vormige eiwitstructuur – want in se zijn antilichamen eiwitten. De vorm bepaalt aan welk type bacterie, virus, kankercel of toxische stof ze kunnen binden. Door zich te binden, kunnen ze de indringer neutraliseren (door de ‘aanlegsteiger’ te bezetten, bijvoorbeeld, zodat hij nergens kan ‘aanmeren’ binnen in het lichaam) of hem vernietigen. Samen vormen de antilichamen een gigantische politiemacht die ons lichaam beschermt tegen de buitenwereld, waar het krioelt van de ziektekiemen, en de gevaren die ons van binnenin bedreigen (kanker, alzheimer, astma).
Antilichamen treffen alleen de aansteker van de ziekte - een virus, een kankercel - en laten gezonde cellen ongemoeid
Helaas is geen enkele verdediging perfect, en dus worden we soms toch ziek. Omdat ons immuunsysteem te traag werkt, zoals bij griep het geval is, of omdat het niet grondig genoeg werkt, zoals bij kanker. En soms is het té actief, wat het geval is bij auto-immuunziekten als reumatoïde artritis en astma.
Maar wat als we de natuur eens een handje zouden helpen? Wat als we de werking van de antilichamen naar believen zouden kunnen aanpassen en uitbreiden?

Muizen
De droom om menselijke antilichamen in het laboratorium te produceren, ze vervolgens de gewenste werking te geven en ze uiteindelijk te injecteren bij patiënten, leeft al sinds 1975. Toen ontdekten de Amerikaanse immunologen George Kohler en Cesar Milstein hoe ze relatief veel antilichamen konden maken. Ze lieten hiervoor immuuncellen van muizen, die in contact waren gebracht met een ziekteverwekker, fuseren met kankercellen. Dankzij de woekerende kankercellen bleef de celcultuur antilichamen produceren. Door vervolgens alleen immuuncellen in cultuur te kweken die krek hetzelfde DNA hadden, konden Kohler en Milstein antilichamen oogsten die volledig identiek waren – ‘monoklonaal’. Eén jaar later, in 1976, slaagde een andere Amerikaan, Ron Levy, erin monoklonale antilichamen te produceren die kankercellen konden herkennen.
Het menselijk lichaam moet die ‘muizen’-antilichamen natuurlijk wel aanvaarden voor ze hun werk kunnen doen. Dat bleek lange tijd een groot obstakel, want net als bij getransplanteerde organen reageerde het lichaam met afstotingsverschijnselen op de ingebrachte vreemde antilichamen. Om die te vermijden, ontwierpen wetenschappers in de voorbije decennia een ‘humanisatieproces’ voor de antilichamen van muizen. Op plaatsen in de eiwitstructuur die niet van belang waren voor de werking plaatsten ze menselijke aminozuren, een arbeidsintensieve en trage ingreep die succes oogstte bij een aanzienlijk deel van de antilichamen. Tegenwoordig gebruiken onderzoekers ook wel eens genetisch gemodificeerde muizen met menselijke immuuncellen, wat het probleem van afstoting voor een groot stuk heeft opgelost.
De droom om menselijke antilichamen in het laboratorium te produceren, leeft al sinds 1975
Een ander probleem had direct te maken met de belangrijkste ziekte die vele onderzoekers met antilichamen wilden bestrijden: kanker. Ron Levy had dan wel een manier gevonden om antilichamen te creëren die kankercellen konden herkennen, ze daarna ook vernietigen konden de antilichamen niet. Het duurde tot het eind van de vorige eeuw voordat onderzoekers erin slaagden een hybride antilichaam te produceren dat succesvol kon worden gekoppeld aan een toxische lading én dat aan kankercellen kon binden. Momenteel worden twee van deze ‘gewapende’ antilichamen gebruikt om kanker te bestrijden (hodgkinlymfoon en borstkanker). In de pijplijn zit nog een dertigtal andere hybride antilichamen die ook andere soorten kanker te lijf zouden kunnen gaan.
Peperduur
Sinds de millenniumwissel is het onderzoek naar therapeutische antilichamen in een stroomversnelling beland. Farmaceutische bedrijven van over de hele wereld zetten de ene na de andere klinische studie op in de hoop tot een succesvol medicijn te komen. Honderden therapeutische antilichamen zitten momenteel in de pijplijn. En die zijn niet allemaal bedoeld om kanker te bestrijden. Noem een ziekte en er bestaat een (experimenteel) antilichaam voor dat specifiek de aansteker van de ziekte aanpakt. Onderzoekers dromen zelfs hardop van antilichamen die fout geplooide eiwitten in de hersenen kunnen opsporen, wat perspectieven zou openen voor een behandeling tegen de ziekte van Alzheimer.
Dat klinkt veelbelovend, maar is het dat ook voor de patiënt? Een behandeling met antilichamen is vaak erg duur en soms gewoonweg onbetaalbaar. In mei 2013 was er in België flink wat heisa rond dit therapeutisch antilichaam, omdat het niet werd terugbetaald en de ouders van de zeven jaar oude Viktor Ameys het niet uit eigen zak konden betalen. Uiteindelijk kon het ministerie van Volksgezondheid niet anders dan Soliris te laten terugbetalen door het ziekenfonds.
Het valt nog af te wachten of overheden en privéverzekeraars bereid zullen zijn de therapeutische antilichamen die nu nog in ontwikkeling zijn, óók allemaal terug te betalen. Is dat niet het geval, dan riskeren deze peperdure behandelingen voorbehouden te zijn voor de happy few.
De nieuwe medicijnen zijn zo duur omdat het kweken van antilichamen in het lab een traag en arbeidsintensief proces is. De eiwitten moeten in dierlijke celculturen worden gekweekt, en dat duwt het prijskaartje gevoelig omhoog.
Kamelen
Maar waarom moeilijk, als het ook makkelijk kan? Of toch in ieder geval veel minder moeilijk? Want er is een alternatief voor gewone antilichamen: mini-antilichamen. Al sinds begin jaren 1990 is bekend dat kamelen, dromedarissen en lama’s naast gewone antilichamen ook mini-antilichamen hebben. Zij hebben een veel minder complexe structuur, maar doen het werk even goed als hun zwaargebouwde soortgenoten. Bovendien zijn deze mini-antilichamen ook tien keer kleiner dan de gewone én ze wegen tot honderd keer minder. Daardoor zijn ze veel behendiger in hun rondgang door het lichaam en kunnen ze binnendringen in celstructuren die voor gewone antilichamen niet toegankelijk zijn. Tot slot zijn ze ook nog eens beter bestand tegen zure milieus en hoge temperaturen, zodat ze makkelijk in onze darmen kunnen overleven.
De ontdekking van de mini-antilichamen begin jaren 1990 is een schoolvoorbeeld van serendipiteit – je vindt door stom toeval iets wat je eigenlijk niet zoekt. De studenten van de Brusselse immunoloog Raymond Hamers, die doceerde aan het Instituut voor Moleculaire Biologie en Biotechnologie op de inmiddels gesloten universiteitscampus van Sint-Genesius-Rode, wilden tijdens hun practicum wel eens wat anders dan muizenbloed analyseren. Hamers stopte hen daarom een fles dromedarisbloed in de handen, afkomstig van een collega die onderzoek deed naar de slaapziekte bij dromedarissen. ‘Een van de proeven tijdens mijn practicum was het uitzuiveren van antilichamen in muizenbloed’, herinnert de nu 83-jarige Hamers zich. ‘Ik dacht: ze kunnen dat evengoed een keertje doen met dromedarisbloed.’
Hamers’ studenten konden, zoals verwacht, de gewone antilichamen identificeren in het dromedarisbloed. Verrassend genoeg vonden ze ook andere, veel kleinere antilichamen die een veel eenvoudigere structuur hadden. Hamers: ‘Dat kon gewoon niet, was mijn eerste reactie. Mijn studenten moesten het experiment hebben verknald. Het leek wel alsof we buitenaards leven hadden gevonden.’ Hamers liet het experiment een aantal keer herhalen, en liet zelfs vers dromedarisbloed uit Kenia overvliegen. Maar weer vond hij tussen de gewone antilichamen de vreemdsoortige mini-antilichamen terug. De volgende stap was controleren of ze wel werkten. Waren het überhaupt wel antilichamen?
Daarvoor had Hamers een staal ziektekiemen nodig waaraan hij muizen kon blootstellen die immuuncellen ingeplant hadden gekregen van een dromedaris. ‘In het buitenland ben ik een grote dosis tetanus gaan halen’, vertelt Hamers. ‘Die heb ik stiekem in m’n jaszak het land in gesmokkeld. Ik had genoeg materiaal bij me om tienduizend mensen te doden!’ En ja hoor, de muizen bleken inderdaad enige tijd aan de tetanus te kunnen weerstaan. De mini-antilichamen werkten.
De toevallige ontdekking van de mini-antilichamen, plus al het werk dat daarna kwam om de eigenschappen van de antilichamen vast te leggen, resulteerde in 1993 in een historisch artikel in Nature.
Maar het belangrijkste gevolg van hun kleiner formaat is het gemak waarmee mini-antilichamen kunnen worden geproduceerd. Het productieproces is daardoor veel goedkoper en duurt voor sommige varianten niet langer dan tien weken. Mini-antilichamen kunnen worden gemaakt in een bioreactor gevuld met gistcellen – een beetje vergelijkbaar met de manier waarop bier wordt gebrouwen. Vertrekken doen de onderzoekers nog wel van dierlijke cellen. Een kameel (of een lama of dromedaris) wordt ingespoten met een ziekteverwekker. Vervolgens zoeken onderzoekers in hun bloed naar de immuuncellen die mini-antilichamen produceren. Ze analyseren het DNA van die cellen en herprogrammeren vervolgens gistcellen om dezelfde antilichamen aan te maken in een bioreactorvat.

De mini-antilichamen hebben tijdens het vorige decennium grote furore gemaakt in de farmawereld. Verschillende therapeutische mini-antilichamen zitten in de pijplijn. Ze worden allemaal ontwikkeld door het Gentse biotechbedrijf Ablynx, dat zijn producten alvast vermarkt heeft onder de merknaam Nanobodies. Het bedrijf heeft de voorbije jaren een tiental klinische studies opgestart voor Nanobodies gericht tegen kanker, trombose, ontstekingsziekten, osteoporose en een rist andere ziekten. Als Ablynx zijn ambities waarmaakt, dan kunnen de Nanobodies een welgekomen aanvulling vormen in het groter wordende arsenaal aan gewone therapeutische antilichamen – eventueel als goedkopere variant. In ieder geval hebben de antilichamen, of ze nu verkregen zijn uit muizen- of kamelenbloed, alles in zich om de magic bullets van de 21ste-eeuwse geneeskunde te worden.