DNA-mutaties in het bloed helpen artsen bij het detecteren van longkanker en het kiezen van de beste behandeling. Helaas zijn deze DNA-mutaties net zo moeilijk te vinden als stripfiguur Wally op een drukke zoekplaat. Tijdens mijn doctoraatsonderzoek zocht ik manieren om deze kostbare mutaties makkelijker op te sporen.
Iedereen die ooit op zoek ging naar Wally, dat mannetje met het rood-wit gestreepte hemd, herkent vast wel dit frustrerende gevoel. Je denkt zelfverzekerd dat je hem direct kunt aanwijzen. Maar de minuten tikken voorbij terwijl je ogen heen en weer glijden over de vrolijke chaos van honderden figuurtjes, tot je uiteindelijk verblind raakt door het bos van kleurrijke mannetjes en Wally niet kunt vinden. Dit gevoel is vergelijkbaar met wat oncologen (artsen gespecialiseerd in kanker) ervaren wanneer ze in een bloedstaal op zoek gaan naar DNA-mutaties. Ze weten dat deze waardevolle informatie ergens aanwezig is; het blijft alleen een enorme uitdaging op deze tussen al het andere op te sporen. Gelukkig heb ik twee oplossingen voor dit probleem gevonden.
Artsen kunnen in een bloedstaal zoeken naar DNA-mutaties die wijzen op longkanker, nog voordat een persoon klachten vertoont
DNA-mutaties zijn kleine foutjes in de genetische informatie van onze cellen. Wanneer deze foutjes ervoor zorgen dat cellen in onze longen zich ongeremd vermenigvuldigen, ontstaan er een gezwel of tumor en spreken we van longkanker. Longkanker is verantwoordelijk voor het hoogste aantal sterfgevallen door kanker, in België en wereldwijd, wanneer we naar zowel mannen als vrouwen kijken. Dit komt niet doordat er meer gevallen van longkanker zijn, wel doordat longkanker vaak heel lang onopgemerkt blijft. De ziekte toont geen duidelijke signalen tot deze al ver gevorderd is en de overlevingskansen klein zijn.
Het is nochtans mogelijk om longkanker wel vroeg op te sporen in het bloed, al is dat niet zo eenvoudig. Ons bloed bevat een zee aan informatie: bloedcellen, eiwitten, suikers en vetdruppeltjes zoals cholesterol. Ons lichaam vervangt voortdurend oude of beschadigde cellen, en wanneer ze sterven, komen er stukjes van hun DNA vrij in het bloed. Wat het voor artsen en onderzoekers nu interessant maakt is dat dit ook gebeurt bij tumorcellen. Dit betekent dat ze door een bloedstaal te nemen op zoek kunnen gaan naar foutjes in dit DNA — de DNA-mutaties — die wijzen op longkanker, nog voordat een persoon klachten vertoont. Door nauwkeuriger te kijken welke DNA-mutatie aanwezig is, kunnen artsen bepalen welke behandeling het beste resultaat zal geven.

Waarom wordt dit dan nog niet toegepast als standaardonderzoek?
In de vroege stadia van de ziekte, wanneer de tumor nog klein is, zijn er heel weinig stukjes DNA die een mutatie bevatten. Een bijkomend obstakel is dat het DNA van tumorcellen in het bloed rondzwemt tussen al het DNA van normale cellen. Hierdoor is het een enorme technologische uitdaging om het zoekproces naar deze waardevolle DNA-mutaties te vereenvoudigen. In mijn onderzoek heb ik twee manieren gevonden om dit aan te pakken.
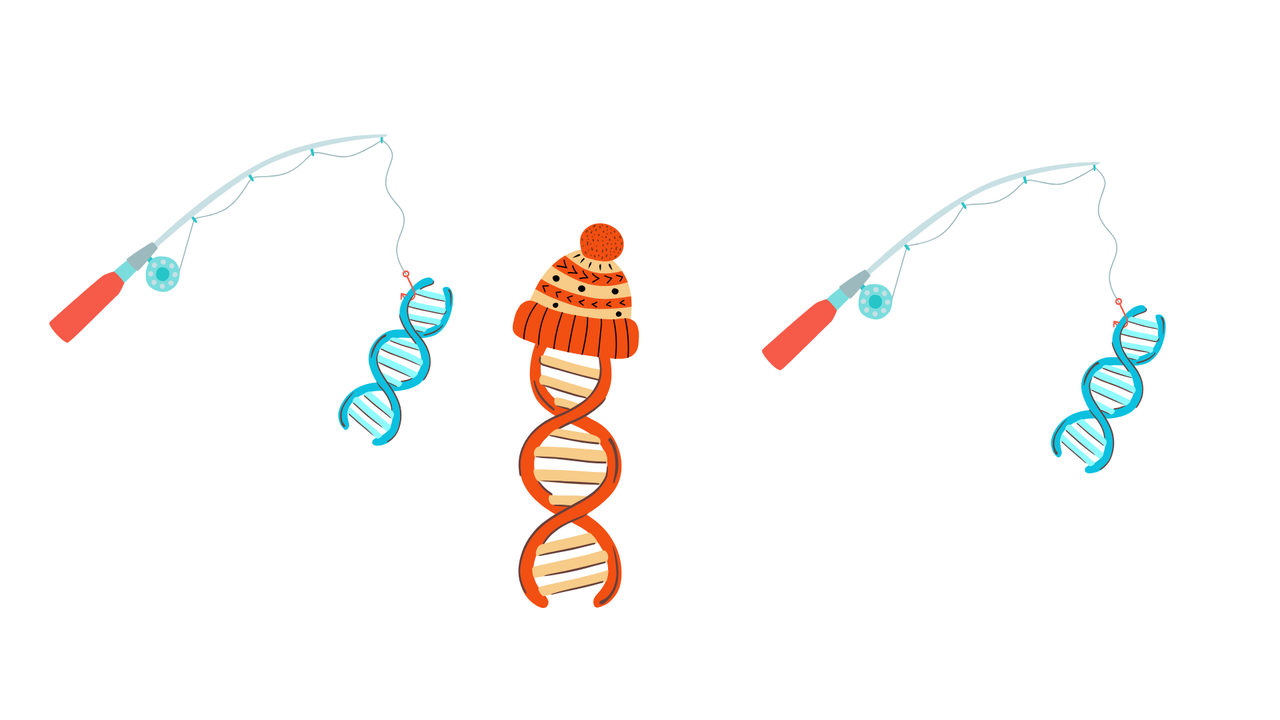
Gezonde stukjes DNA wegvissen
De eerste manier zorgt ervoor dat we stukjes met een DNA-mutatie veel gevoeliger kunnen opsporen, zelfs als hun concentratie heel laag is ten opzichte van alle andere DNA stukjes. DNA bestaat uit twee strengen die rond elkaar gedraaid zijn. Wanneer je de strengen ontrafelt, versmelten ze zo snel mogelijk weer met elkaar, wat men hybridisatie noemt. Deze hybridisatie gaat het beste wanneer de twee strengen elkaars perfecte spiegelbeeld zijn, zoals je eigen twee handen die mooi in elkaar passen. Ik maakte gebruik van deze eigenschap om mijn techniek op te bouwen.
Op een hybridisatieplaat plaatste ik duizenden stukjes DNA die het spiegelbeeld vormen van ons gezonde DNA, en maar een tiental die het spiegelbeeld vormen van de stukjes DNA met een mutatie. De gezonde stukjes DNA doen dienst als vislijnen, en vissen het overgrote deel van het DNA uit onze gezonde cellen weg, waardoor enkel de stukjes met een DNA-mutatie overblijven. Je kan dit vergelijken met het wegstrepen van heel veel mannetjes uit een ‘Waar is Wally?’-prent, waardoor de speurtocht naar Wally meteen veel makkelijker wordt.
Door deze nieuwe methode toe te passen, kon ik een tien keer lagere concentratie aan DNA-mutaties detecteren dan zonder het wegvissen dan de gezonde stukjes DNA. In samenwerking met het Jessa Ziekenhuis in Hasselt bevestigde ik de werking van deze methode op stalen van 18 longkankerpatiënten.
Toch zijn er nog belemmeringen. Deze hybridisatietechniek is goed in het opsporen van één of enkele bekende foutjes. Daardoor is ze ideaal om verder te ontwikkelen als hulpmiddel tijdens een behandeling om te controleren of deze aanslaat, of om te bepalen wanneer er beter van therapie veranderd wordt. De keerzijde is dat deze techniek niet geschikt is om alle mogelijke DNA-mutaties tegelijk op te sporen en dus minder bruikbaar is voor vroege diagnose.
Kunnen blaasjes ons iets wijsmaken?
Als tweede manier heb ik de opzuivering van de stukjes DNA uit het bloed onder de loep genomen. Kankercellen sturen namelijk ook voortdurend boodschappen door het bloed. Deze zien eruit als kleine blaasjes met daarin informatie, zoals DNA-stukjes, verpakt. Deze blaasjes worden extracellulaire vesikels genoemd en beschermen de stukjes DNA in het bloed. Je kunt het vergelijken met een breekbaar pakketje dat verpakt is in bubbelfolie. Omdat het de levende kankercellen zijn die deze blaasjes verzenden, komen ze nog eerder vrij in het bloed dan losse stukjes DNA.
In dit deel van mijn onderzoek optimaliseerde ik methoden om deze blaasjes uit het bloed te halen en te bestuderen. Hiervoor verzamelde ik bloedstalen van gezonde vrijwilligers. Daarnaast kweekte ik longkankercellen in het laboratorium om blaasjes (alleen of samen met losse stukjes DNA) met een bekende mutatie toe te voegen aan de bloedstalen. Vervolgens gebruikte ik de standaardmethode, of een methode waarbij ik eerst de blaasjes isoleerde om de DNA-mutatie terug te vinden. Voor de DNA-analyse gebruikte ik twee verschillende technieken, met elk unieke voordelen.
- Digitale PCR is een zeer gevoelige techniek die meerdere mutaties tegelijk kan opsporen, maar het aantal blijft wel beperkt.
- Next generation sequencing daarentegen is iets minder gevoelig maar kan volledige sets van bekende mutaties tegelijk bestuderen.

Met beide DNA-analyse technieken vond ik een hogere concentratie aan DNA-mutaties wanneer ik eerst de blaasjes uit het bloed opzuiverde vergeleken met de standaardmethode. Omdat de DNA-mutaties in de blaasjes beter beschermd zijn, kun je gerichter zoeken, alsof iemand je in een ‘Waar is Wally?’-prent van tevoren zegt op welk deel van het blad je moet zoeken.
Deze methode moet nog verder getest worden op longkankerpatiënten, maar toonde alvast veelbelovende resultaten in mijn onderzoek om de zoektocht naar DNA-mutaties te verbeteren en longkanker eerder op te sporen. Dit kan leiden tot effectievere behandelingen en een betere levensverwachting voor de patiënt.