Fotoporatie is een nieuwe en veilige methode om moleculen van buitenaf in cellen te plaatsen, met als doel die genetisch te wijzigen. Zo kunnen bijvoorbeeld immuuncellen, eens teruggebracht in de patiënt, beter ziektes zoals kanker bestrijden. Eos sprak met professor Kevin Braeckmans, hoofd van de onderzoeksgroep biofotonica aan de Universiteit Gent en bedenker van het innovatieve proces.
Beeld: Illustratie van kankercellen. Belgaimage.
Wat is fotoporatie en hoe gaat het in zijn werk?
‘Fotoporatie is een technologie om moleculen van buitenaf in cellen binnen te brengen om die genetisch te wijzigen. Dat kan je doen door bijvoorbeeld een stukje DNA in de cel te brengen.’
‘Het is lastig om moleculen zomaar in cellen binnen te brengen, omdat cellen beschermd worden door hun buitenste celmembraan. Je hebt daarvoor gespecialiseerde technologie nodig. De uitdaging bestaat erin om technologie te ontwikkelen waarbij de cel zo min mogelijk beschadigd wordt. Je wil wel iets in de cel binnenbrengen, maar tegelijkertijd de cel zo gezond mogelijk achterlaten.’
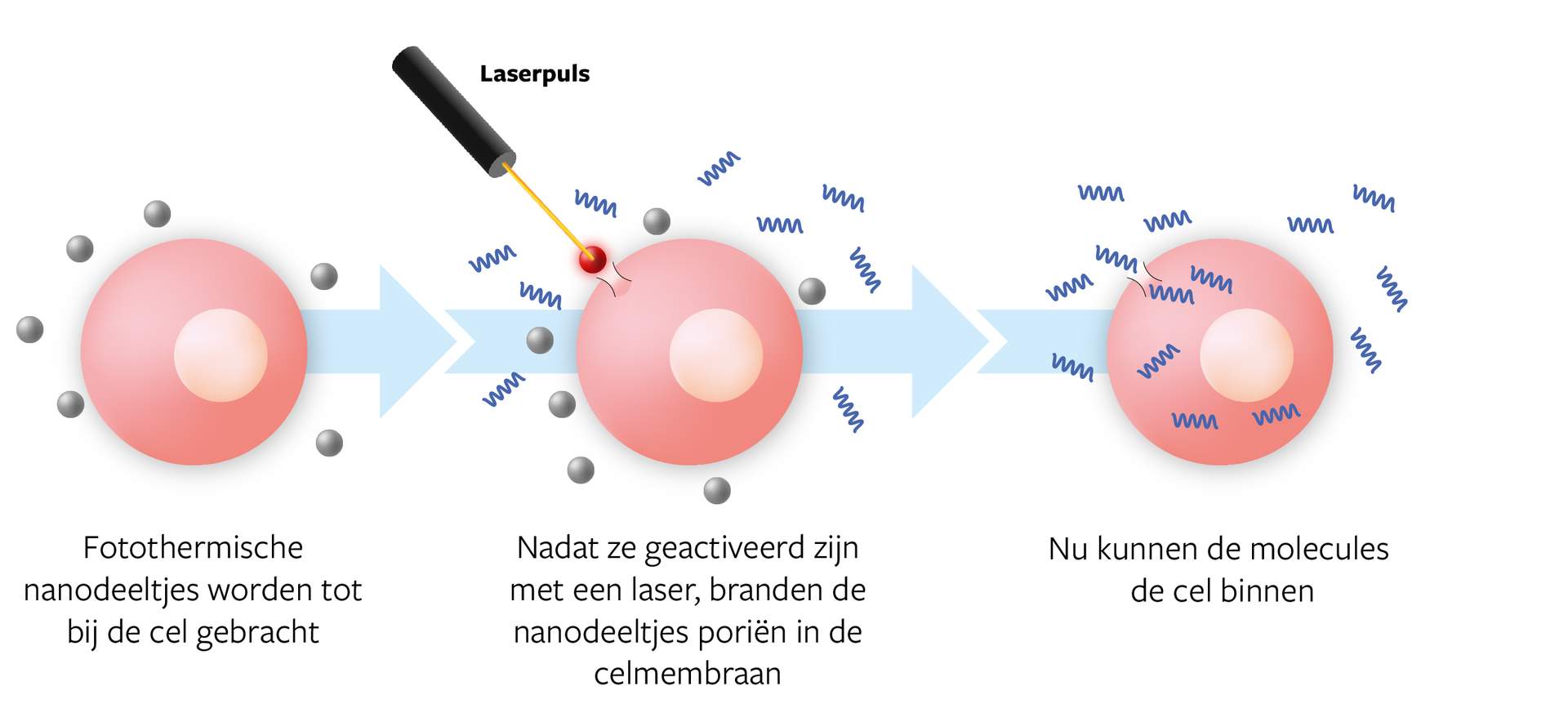
‘Fotoporatie werkt als volgt: we hebben cellen in cultuur en we voegen er fotothermische nanodeeltjes aan toe. Die zodanig zijn ontworpen dat ze laserlicht kunnen absorberen en die lichtenergie kunnen omzetten in warmte en mechanische energie. Wanneer die kleine nanodeeltjes in de buurt van het celmembraan zijn en je ze activeert met gepulseerd laserlicht, dan warmen ze sterk op en branden ze heel kleine tijdelijke gaatjes in het buitenste celmembraan. Daardoor kunnen moleculen de cellen binnendringen, met minimale invloed op de levensvatbaarheid en functionaliteit van de cel. Dat gebeurt zeer lokaal, dus alleen in de nabijheid van waar die kleine nanodeeltjes aanwezig zijn.’
‘Ons onderzoek toont aan dat dat een heel zachte manier is om die cellen te gaan behandelen, net omwille van het feit dat de minimale schade die je toebrengt zeer lokaal is en zeer precies gecontroleerd wordt. Ik noem fotoporatie dan ook wel eens nanochirurgie, omdat we heel lokaal heel kleine gaatjes in het buitenste celmembraan maken, zodanig dat moleculen van buitenaf naar binnen kunnen in die cel.’
Wat zijn concrete toepassingen van fotoporatie?
‘Het genetisch wijzigen van cellen heeft tal van toepassingen. Het wordt nu al gebruikt in puur fundamenteel onderzoek, waar men tracht genen in en uit te schakelen, bijvoorbeeld om te kijken hoe ze verwant zijn aan bepaalde ziektebeelden.’
‘Wij richten ons vooral op belangrijke praktische toepassingen. Bijvoorbeeld immuuncellen genetisch wijzigen zodat ze, na teruggebracht te zijn in de patiënt, beter in staat zijn ziektes zoals kanker te bestrijden. Het beste voorbeeld daarvan is de CAR T-celtherapie, een behandeling waarbij T-cellen eerst worden geïsoleerd uit het bloed van kankerpatiënten, ze vervolgens genetisch worden gewijzigd zodat ze beter in staat zijn kankercellen op te sporen en te doden. Vervolgens worden ze teruggebracht in de patiënt om de kanker te behandelen.’
Hoe gebeurde dat tot nu toe? En wat waren de nadelen daarvan?
‘De manier waarop in de huidige therapieën cellen genetisch gewijzigd worden, is door gebruik te maken van virale vectoren. Dat zijn virussen die voor een groot stuk onschadelijk gemaakt worden en waarvan het genoom wordt vervangen door een therapeutisch stukje DNA dat je in de cel wilt plaatsen om ze genetisch te wijzigen. Je maakt daarbij gebruik van de natuurlijke mogelijkheid van virussen om genetische code binnen te brengen in cellen. Normaal doen ze dat om zichzelf te gaan vermenigvuldigen, maar nu wordt datzelfde proces gebruikt om een artificieel gen binnen te brengen in de cel.’
‘Maar er zijn een aantal moeilijkheden met die virale vectoren. Ze zijn duur om te produceren, omdat daar speciale, langdurige processen voor nodig zijn. Dat maakt de huidige celtherapieën die daarop gebaseerd zijn behoorlijk duur.’
‘Daar komt nog bij dat die methode heel wat voorbehandelingstappen vereist om de virussen goed te kunnen accepteren en de transfectie – het binnendringen – goed te laten verlopen. Dat maakt dat het productieproces van de huidige CAR-T-celtherapieën soms twee tot drie weken duurt. Dat betekent dat kankerpatiënten die dringend moeten behandeld worden vaak meerdere weken op hun behandeling moeten wachten.’
‘In de toekomst hopen we een apparaat te ontwikkelen dat volledig geautomatiseerd cellen van patiënten kan behandelen in enkele uren tijd’
‘Een ander belangrijk probleem zijn de veiligheidsbezorgdheden die gepaard gaan met het gebruik van virussen. Want virussen gaan de genetische code insluiten in het genoom van de cel, maar waar ze dat exact doen is zeer willekeurig. En daarmee krijg je het gevaar dat je genen gaat verstoren in de natuurlijke werking van de cel, en dat die op zich ook aanleiding kunnen geven tot de vorming van kanker. Er zijn een aantal rapporten waarbij er toch wel bezorgdheid is dat er in patiënten die behandeld zijn met de huidige CAR-T-therapieën ook secundaire kankers kunnen optreden. Dat zou ook wel eens te maken kunnen hebben met die virale vectoren, al is men daar nog niet zeker van.’
‘Vanwege al die problemen met virale vectoren zou het toch voordelig zijn viraal-vrij te kunnen gaan: het is een stuk goedkoper, de processen gaan sneller, en je hebt ook veiligheidsvoordelen. Daarom dat wij, maar ook anderen, op zoek zijn naar nieuwe technologieën die vrij zijn van virussen om die cellen genetisch te wijzen.’
‘Alternatieve vectorvrije benaderingen zoals elektroporatie – het gebruik van elektriciteit om poriën te vormen in het celmembraan – werken redelijk goed, maar zijn vaak schadelijk voor de cellen. Bedrijven vermelden meestal hoeveel cellen elektroporatie overleven, maar niet hoeveel cellen daarna nog gezond functioneren. Geëlektroporeerde cellen hebben doorgaans meerdere dagen nodig om te herstellen en weer te groeien, als ze dat al doen. Met fotoporatie presteren we beter dan dat.’
‘We hebben op dit moment een instrument dat marktklaar is, maar dat uitsluitend gebruikt wordt voor onderzoeksdoeleinden, niet voor de productie van celtherapie omdat die moet voldoen aan heel strikte regelgeving en kwaliteitsnormen. Daaraan zijn we nu volop aan het werken. We verwachten daarmee klaar te zijn binnen twee à drie jaar.’
‘In de toekomst hopen we een apparaat te ontwikkelen dat volledig geautomatiseerd cellen van patiënten kan behandelen in enkele uren tijd, wat de kosten verlaagt en de productie versnelt. Dat zou ook ziekenhuizen kunnen helpen om zelf celtherapieën te produceren, waardoor behandelingen betaalbaarder en sneller beschikbaar worden.’
Trince (TRansfer INto CElls), de innovatieve spin-off van de Universiteit Gent die de fotoporatietechniek ontwikkelde, won de wereldwijde Spinoff Prize van het wetenschappelijk tijdschrift Nature.