De meeste antidepressiva zijn erop gericht de hoeveelheid serotonine in de hersenen te verhogen. Toch heeft serotonine weinig of niets te maken met depressie.
Waarom word je depressief? Vaak hoor je de volgende verklaring: in de hersenen van depressieve mensen is er een tekort aan de neurotransmitter serotonine. Dat veroorzaakt neerslachtigheid. Medicijnen die de serotonineconcentratie verhogen, corrigeren dat onevenwicht en verbeteren op die manier de stemming.
Deze ‘serotoninehypothese’ gaat terug tot 1969. Onderzoekers vergeleken het hersenvocht van depressieve patiënten met dan van gezonde mensen, en stelden vast dat er minder van een afbraakproduct van serotonine in zat. Twee Russische wetenschappers opperden toen dat een gebrek aan serotonine depressie veroorzaakt.
Vanwege het effect op de stemming wordt serotonine ook wel het gelukshormoon genoemd. Veel serotonine zorgt voor een euforisch gevoel – denk aan ecstacy, dat de hoeveelheid serotonine verhoogt. De neurotransmitter heeft echter nog meer in zijn mars. Serotonine kan zich binden aan meerdere receptoren en zo talrijke reacties uitlokken. De naam is afgeleid van het effect op de bloeddruk – als bestanddeel van het serum reguleert het de spanning van de bloedvaten. Het heeft ook een effect op de activiteit van maag en darmen en maakt de communicatie tussen neuronen makkelijker. Behalve de stemming beïnvloedt de stof ook het gevoel van pijn, de eetlust, het slaap-waakritme en de lichaamstemperatuur. Een overdosis serotonine leidt tot een snelle hartslag, zweten, misselijkheid en hoofdpijn. Dit ‘serotoninesyndroom’ kan fataal aflopen, meestal als gevolg van druggebruik.
Slapen en roken
De serotoninehypothese maakte al snel opgang in de wetenschappelijke wereld. Ook omdat ze een verklaring bood voor de werking van bepaalde medicatie tegen depressie. Toentertijd waren de eerste stemmingsverbeterende middelen beschikbaar. Ze werden niet specifiek ontwikkeld als antidepressiva, maar toevallig ontdekt. Het ging eigenlijk om middelen voor de behandeling van tuberculose. Tijdens tests met iproniazide in de jaren 1950 merkten artsen op dat de stemming van hun patiënten verbeterde. Iproniazide remt het enzym monoamine-oxidase (MAO), dat de neurotransmitters noradrenaline, serotonine en dopamine afbreekt. Daardoor neemt de concentratie van deze neurotransmitters toe in de zenuwcel en in de synaptische spleet – de nauwe ruimte die onderling verbonden neuronen scheidt. Iproniazide werd in 1958 goedgekeurd voor de behandeling van depressies. Slechts enkele jaren later verdween het echter uit veel apotheken, omdat het soms ernstige bijwerkingen veroorzaakte.
Rond dezelfde tijd werd ook imipramine ontdekt, een middel dat minder problemen geeft. Het geneesmiddel is onder de naam Tofranil verkrijgbaar in België en Nederland. Dit medicijn behoort tot een groep van geneesmiddelen die bekendstaan als tricyclische antidepressiva (TCA’s). Deze stoffen voorkomen dat zenuwcellen de neurotransmitters serotonine, noradrenaline en dopamine weer opnemen na hun afgifte in de synaptische spleet. Net zoals de MAO-remmers verhogen ze daar dus de concentratie van serotonine.
Lithiumzouten werden in de 19de eeuw gebruikt voor de behandeling van jicht. In de jaren 1880 ontdekten de Deense broers Carl en Fritz Lange het antidepressieve potentieel van deze stoffen. In de eerste helft van de 20ste eeuw werd hun ontdekking echter vergeten. De Australische arts John Cade, die het middel gebruikte om manie te behandelen, maakte in 1949 de weg vrij voor lithium in de psychiatrie. Vandaag worden de metaalzouten nog steeds voornamelijk gebruikt voor bipolaire stoornissen. Daarnaast nemen sommige depressieve patiënten ze in om een terugval te voorkomen of aanvullend om het effect van voorgeschreven antidepressiva te versterken. Het is nog steeds niet duidelijk hoe lithium werkt bij depressie.
De serotoninehypothese bood dus een verklaring voor het ontstaan van depressie en voor de werking van medicatie. Tal van onderzoeksgroepen probeerden de theorie een solide wetenschappelijke basis te verlenen. Bij overleden depressieve patiënten bepaalden ze de concentratie van serotonine en zijn afbraakproduct (5 HIAA of 5-hydroxy-indolyl azijnzuur) in de hersenvloeistof. Uit deze waarden leidden ze vervolgens de hoeveelheid serotonine in de hersenen af.
In 1980 vatte de Zweedse arts Carl-Gerhard Gott Fries de bevindingen van verscheidene studies samen. Verrassend genoeg bleek er geen verband te bestaan tussen de hoeveelheid serotonine en depressie. Ook metingen voor en na een behandeling lieten geen verhoogde serotonineconcentraties zien.
Tot nu toe heeft geen enkel onderzoek op een overtuigende manier een serotoninetekort kunnen aantonen bij depressie. “Er bestaat geen duidelijk verband tussen serotonineniveaus en depressieve symptomen”, zegt Andreas Heinz, directeur van de afdeling Psychiatrie en Psychotherapie van het Charité-ziekenhuis in Berlijn.
Toch speelt serotonine een belangrijke rol. Maar de concentratie van de neurotransmitter in de hersenen fluctueert voortdurend. “Slapen en roken, bijvoorbeeld, hebben invloed op het serotoninesysteem”, vervolgt Heinz.
Een makkelijk verhaaltje
Andere experts staan ook uiterst kritisch tegenover de serotoninehypothese. De Duitse depressie-onderzoeker Ulrich Hegerl benadrukt dat geen enkele wetenschapper nog gelooft in dit eenvoudige model. “De zaak is veel complexer dan een enkele boodschapperstof”, verduidelijkt hij. Psychiater Tim Kendall, die medeauteur was van de Britse richtlijnen voor de behandeling van depressies, legde het nog drastischer uit aan het weekblad Die Zeit in 2016: “De serotoninehypothese is volslagen onzin.” Hij noemt het idee dat een enkele boodschapperstof verantwoordelijk zou zijn voor depressie ‘belachelijk’.
In de wetenschappelijke wereld speelt de serotoninehypothese nagenoeg geen rol meer. Toch zijn er nog steeds artsen die deze verklaring aan patiënten verkopen als oorzaak van hun ziekte. Peter Falkai, professor psychiatrie en psychotherapie aan de Ludwig Maximilian Universiteit in München, gelooft dat het gewoon handig is om serotoninetekort als uitleg te gebruiken. Psychiater en psychotherapeut Jan Dreher van de Königshof Kliniek in Krefeld denkt er ook zo over: “Chemische onbalans in de hersenen klinkt gewoon goed.”
Niet alleen sommige artsen, maar ook de farmaceutische industrie klampt zich deels vast aan dit vereenvoudigde beeld. De serotoninehypothese kan de werking van veel antidepressiva op een eenvoudige en voor de hand liggende manier verklaren. Dat is een van de belangrijkste redenen waarom ze in 1969 zo goed werd ontvangen – en waarom ze vandaag nog steeds zo populair is.
“Het brein bevindt zich permanent in een staat van opwinding. Je kunt niet ontspannen, niet slapen”
Bewijzen van het tegendeel
Op basis van het verklaringsmodel voor serotonine en het succes van vroege antidepressiva ontwikkelden farmaceutische bedrijven tal van andere geneesmiddelen met vergelijkbare werkingsmechanismen. De meest voorgeschreven geneesmiddelen zijn tegenwoordig medicijnen die de heropname van serotonine in neuronen voorkomen: de zogenaamde SSRI’s of selectieve serotonineheropnameremmers. Ze staan bekend onder de namen Sertraline, Citalopram en Fluoxetine. Selectieve serotonine/norepinefrine heropnameremmers (SNRI’s) zoals Venlafaxine worden ook vaak gebruikt.
Geneesmiddelen van beide groepen voorkomen dat bepaalde eiwitten de vrijgekomen serotonine terugvoeren naar de zenuwcel (zie ‘Focus op de synapsen’). Zo verhogen de medicijnen de hoeveelheid van de neurotransmitter in de synaptische spleet al kort na inname. Toch duurt het meestal enkele weken voordat patiënten zich beter gaan voelen. Voor veel experts, onder wie Falkai en Dreher, is het vertraagde effect een belangrijk argument tegen de serotoninehypothese. Als de toename van serotonine verantwoordelijk zou zijn voor het effect, dan zou de verlichting kort na inname moeten volgen.
Een ander tegenvoorbeeld is het antidepressivum tianeptine. Het geneesmiddel wordt beschouwd als een serotonineheropname-versterker (SRE): het wordt verondersteld de heropname van serotonine te stimuleren en zo de concentratie in de synaptische spleet te verminderen. Dat is precies het tegenovergestelde van wat SSRI’s doen. De stof is in België op recept verkrijgbaar. Of de stof ook echt doet wat ze verondersteld wordt te doen, wordt betwijfeld. Bupropion, nog een ander antidepressivum, remt de opname van dopamine en noradrenaline, maar niet die van serotonine. In onderzoek is aangetoond dat beide medicijnen soortgelijke effecten hebben als SSRI’s.
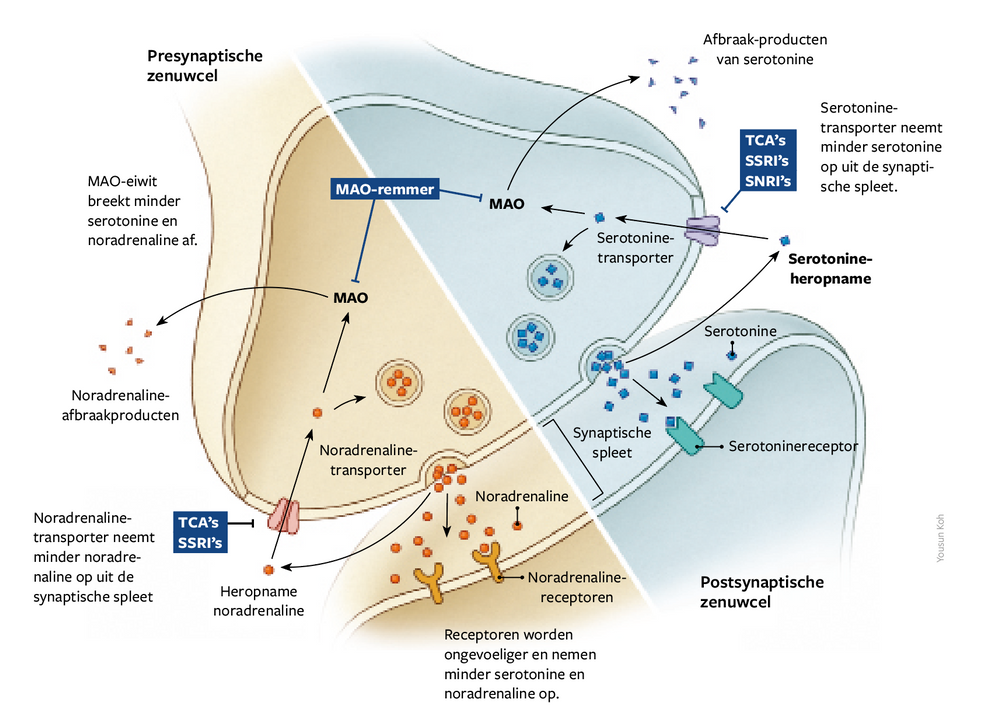
Focus op de synapsen
De neuronen communiceren met elkaar via de synapsen, deels door middel van chemische signalen die bekendstaan als neurotransmitters. Antidepressiva grijpen in op dat proces. Werkzame stoffen uit de groep van de SSRI’s blokkeren de serotonine-transporter van neuronen die serotonine afgeven. Dat verhoogt de hoeveelheid van de signaalmolecule in de synaptische spleet. SNRI’s en TCA’s beïnvloeden zowel serotonine- als noradrenalinereceptoren. MAO-remmers voorkomen dat het eiwit monoamine oxidase (MAO) de neurotransmitters afbreekt, waardoor die zich ophopen in de cel en in grotere hoeveelheden vrijkomen.
Krimpende hersenen
Experts zijn het erover eens dat er meer aan de hand is dan een verstoorde serotoninebalans. Er bestaan verscheidene theorieën over de mogelijke mechanismen. Een oudere is de ‘monoaminehypothese’. Die houdt in dat de ziekte niet wordt veroorzaakt door een gebrek aan serotonine alleen, maar door een onevenwicht van meerdere monoamines – naast serotonine ook noradrenaline en dopamine. In 1965 werden verschillende psychische stoornissen op die manier verklaard. Niet lang daarna is op basis van dit model de serotoninehypothese ontwikkeld. “Aangezien sommige mensen reageren op SSRI’s en SNRI’s, is er onder experts nog steeds de nodige discussie over de monoaminehypothese”, licht Falkai toe. De medicijnen veroorzaken niet alleen een ophoping van serotonine; ze beïnvloeden meestal ook het vrijkomen van andere neurotransmitters, zoals dopamine en noradrenaline.
Falkai en Dreher geven de voorkeur aan een andere uitleg. Daarin speelt de neuronale plasticiteit een centrale rol. Dat is het vermogen van de hersenen om zichzelf voortdurend te herorganiseren. Het brein kan neuronen laten ontkiemen en integreren. Verbindingen tussen neuronen worden sterker of zwakker, de hersencellen verbreken synapsen of verbinden zich met elkaar. Zulke herstructureringen treden bijvoorbeeld op wanneer we iets leren of gebeurtenissen opslaan in ons geheugen.
Bij depressieve patiënten zijn bepaalde delen van de hersenen, zoals de hippocampus (gelinkt met het geheugen) en de prefrontale cortex (betrokken bij planning, impulsbeheersing en sociaal gedrag), aanzienlijk kleiner dan bij de gezonde bevolking. Hoe langer de ziekte aanhoudt, hoe meer deze hersengebieden krimpen. Langdurige stress, een risicofactor voor depressie, kan er eveneens toe leiden dat de hersenen krimpen. In het brein van overleden patiënten hebben onderzoekers een kleiner aantal synapsen aangetroffen. Verder kunnen epigenetische veranderingen die zijn uitgelokt door stress of traumatische ervaringen de plasticiteit van de hersenen aantasten en uiteindelijk tot een depressie leiden. Bij epigenetische wijzigingen hechten methylgroepen zich aan het DNA, waardoor genen al of niet kunnen worden ‘uitgelezen’.
Volgens cijfers uit 2018 slikken 1 miljoen Nederlanders en 1,2 miljoen Belgen antidepressiva. Niet iedereen heeft er baat bij, en bij de helft van de mensen voor wie ze wel werken, treedt slechts een lichte verbetering van de symptomen op.
Onderzoek heeft aangetoond dat een combinatie van medicatie en psychotherapie effectiever is voor ernstige depressies dan een van beide behandelingen op zich. In milde gevallen wordt zowel in België als in Nederland geen medicatie aangeraden. Antidepressiva zouden in dat geval niet beter werken dan een placebo.
Dat geldt niet voor dysthymie, een milde, maar chronische vorm van depressie. Daarbij werken antidepressiva door de bank genomen sneller dan psychotherapie. Daarom is medicatie bij deze aandoening de eerste keuze.
Experts gaan ervan uit dat de neuronale plasticiteit bij mensen met een depressie beperkt is. Misschien krikken antidepressiva die weer op, volgens werkingsmechanismen die we nog niet kennen.
Als dat klopt, dan zijn er misschien medicijnen die veel beter geschikt zijn dan de conventionele SSRI’s en SNRI’s. Zoals esketamine, een middel dat eind 2019 is goedgekeurd. Het is als neusspray op de markt voor moeilijk te behandelen depressies, en blijkt bij sommige patiënten de symptomen al enkele uren na het eerste gebruik te verlichten. De stof zou de productie van bepaalde eiwitten stimuleren die de vorming van meer nieuwe synapsen in de hand werken.
De voordelen van slaaptekort
En dan is er de theorie van verhoogde arousal. Een onderzoek met eeg (elektro-encefalografie, waarbij de elektrische activiteit van het brein wordt gemeten, red.) wees uit dat het brein van depressieve patiënten een verhoogde arousal laat zien. Hun brein is als het ware permanent in een staat van opwinding.
“Ze kunnen zich niet ontspannen, hebben moeite om in slaap te vallen en om door te slapen”, zegt Hegerl, die de theorie ontwikkelde. En, opvallend: na slaaptekort nemen de symptomen bij veel depressieve mensen abrupt en minstens tijdelijk af (zie Psyche&Brein nr. 5, 2016). Hegerls model biedt daar een verklaring voor. “Slaaptekort versterkt de slaapbevorderende hersenmechanismen en gaat zo de arousal tegen”, verduidelijkt hij. Ook esketamine, de nieuwe neusspray, kan in dit plaatje passen, want de stof heeft een verdovend effect.
Daarnaast zijn er conventionele antidepressiva die de activiteit in de locus caeruleus zouden stilleggen. Deze hersenkern in de achterhersenen is betrokken bij de regulering van waakzaamheid en arousal. Volgens Hegerl verzwakken de medicijnen mogelijk de arousal die met depressie gepaard gaat.
Er circuleren nog meer theorieën. Mogelijk spelen ontstekingsreacties een rol. Veel patiënten hebben hoge ontstekingswaarden in hun bloed. Studies met ontstekingsremmers hebben tot nog toe echter een bescheiden of helemaal geen effect aangetoond.
Er zijn steeds meer aanwijzingen dat de darmflora je stemming beïnvloedt
Ook de darmflora kan invloed hebben. Er zijn steeds meer aanwijzingen dat darmbacteriën de stemming beïnvloeden, via de zogenoemde darm-hersenas. De talloze bacteriën in de darmen verteren niet alleen ons voedsel. Ze produceren ook stoffen die een effect hebben op ons brein, waaronder dopamine en serotonine. Het merendeel van de serotonine in ons lichaam is afkomstig van de darmbacteriesoort Bifidobacterium infantis. De darmflora kan sterk verschillen van individu tot individu, en stress kan de samenstelling van micro-organismen aanzienlijk veranderen.
Deze recente theorieën en bevindingen beïnvloeden de ontwikkeling van nieuwe medicijnen, zoals esketamine. Onder meer hallucinogene middelen als psilocybine en hersenstimulatie trekken de aandacht van onderzoekers.
Dat is hoopgevend, vooral voor patiënten bij wie de gebruikelijke antidepressiva niet aanslaan – en dat zijn er heel wat. Maar ook bij de nieuwe middelen geldt: ze werken niet voor iedereen.
Mogelijk spelen uiteenlopende processen een rol bij de ziekte. Het mysterie van de oorzaak of oorzaken van depressie zal onderzoekers nog wel enige tijd bezighouden.



