Biofysicus Derick Yongabi en zijn collega’s Patrick Wagner en Marc Fransen (KU Leuven) deden een fascinerende ontdekking. Kleine genetische en fysiologische verschillen zorgen ervoor dat cellen in oplossing op een verschillend moment beginnen te bewegen. Zij zien een grote toekomst in de diagnostiek van kanker en genetische aandoeningen, en bij medicijnontwikkeling.

Jullie ontdekten dat cellen in een fysiologische zoutoplossing bij een bepaalde temperatuur allemaal tegelijk beginnen te bewegen. Was dat een verrassing?
‘Het was compleet onverwacht! We onderzochten die cellen met een klein meettoestel met een miniatuurthermometer. Onderaan zit een chip, die we kunnen opwarmen. Je zou verwachten dat de cellen naar beneden zinken in het toestel, en daar blijven liggen. Maar wij zagen dat de warmtegeleiding aan het oppervlak van onze chip na een bepaalde tijd veranderde. Alsof de cellen niet meer op het oppervlak van de chip lagen. En dat was ook zo. We konden in beeld brengen dat de cellen plots begonnen te bewegen of roteren. Op het warme oppervlak vormden ze een uitstulping die ze optilde.
Nog verrassender was dat de cellen plots én allemaal tegelijk loskomen van de chip, alsof ze dat onderling hadden afgesproken.’
Als ze tot eenzelfde cellijn behoorden, tenminste.
‘Ja, gistcellen van dezelfde stam bewogen op hetzelfde moment. Andere cellijnen bewogen ook tegelijk, maar op een ander moment. Bij kankercellen zagen we hetzelfde. Het moment van loskomen is bovendien gelinkt met het metabolisme van de cellen. Cellen met een lager metabolisme blijven langer liggen. Gezonde en weldoorvoede cellen komen sneller los. Bij gewone gist uit de supermarkt zie je direct of hij de houdbaarheidsdatum heeft overschreden. In dat geval blijven gistcellen op de bodem liggen. Misschien kunnen we dus ook de activiteit en daarmee de kwaadaardigheid van kankerlijnen bepalen.’
Wat betekent jullie ontdekking voor de geneeskunde?
‘We gaan nu een aantal toepassingen testen om de techniek te valideren, en we gaan het toestel verbeteren. We willen het effect van medicijnen op kankercellen testen. Als het medicijn goed werkt, moeten de kankercellen doodgaan, of op zijn minst minder actief worden. Dat moet dit toestel kunnen detecteren.’
‘Mogelijk kunnen we ook de diagnose van erfelijke stofwisselingsstoornissen vereenvoudigen. Alleen door naar de symptomen te kijken kan je bijna onmogelijk zeggen welk genetisch defect een patiënt heeft. De diagnose steunt nu vooral op biochemisch en moleculair-genetisch onderzoek. Wij verwachten dat de cellen van patiënten met verschillende genetische defecten op een verschillend moment zullen bewegen.’
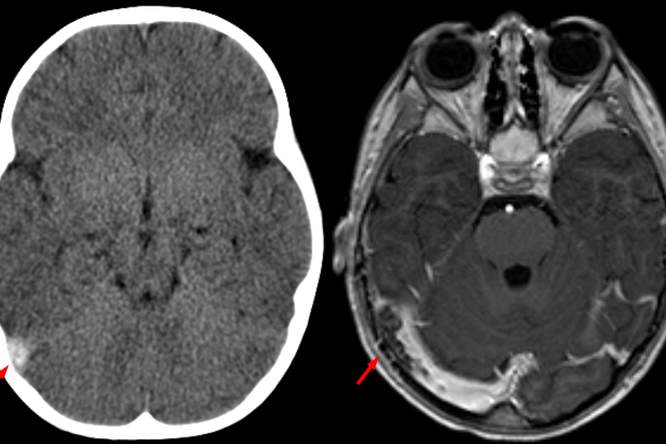
Beeld: Wikimedia