Axolotls regenereren ledematen en organen. Door twee genen die daarvoor instaan te bestuderen, hopen onderzoekers inzichten te verwerven voor weefselherstel bij mensen.
Axolotls zien er niet alleen eigenaardig uit, ze hebben ook een merkwaardige vaardigheid. De salamander kan beschadigde weefsels laten regenereren. Het is een eigenschap die ze delen met andere amfibieën. Ook diersoorten als rondwormen en zebravissen kunnen onderdelen van hun lichaam regenereren. Al blinken salamanders er wel in uit. ‘Ze kunnen hele ledematen, hun staart, organen, ogen en grote stukken van hun zenuwstelsel herstellen, en dat hun hele leven lang’, zegt herpetoloog Raoul Van Damme (Universiteit Antwerpen). ‘Dat zie je niet bij andere diersoorten.’
Onderzoekers tonen al langer interesse in axolotls en hun bijzondere genen. Eerder legden wetenschappers bijvoorbeeld al een inventaris aan van honderden genen die de salamander mogelijk helpen bij het regenereren van de ledematen. Onder meer met het oog op toekomstige toepassingen bij mensen. Het maakt van de axolotl een vaak geziene gast in laboratoria.
'Axolotls zijn het amfibische equivalent van de fruitvlieg en de laboratoriumrat’
‘Nochtans is die soort zeker niet de kampioen van de regeneratie’, zegt Van Damme. ‘Andere veelgebruikte studiesoorten, zoals de groene watersalamander, de Japanse vuurbuiksalamander en de ribbensalamander, kunnen zwaarder beschadigde structuren regenereren, en ze kunnen dat tot op een hogere leeftijd. Onderzoekers verkiezen de axolotl vooral omdat hij eenvoudig te verkrijgen is in de handel en makkelijk te onderhouden is. Bovendien bestaan er verschillende genetische lijnen van deze salamander, hierdoor kan je specifiekere onderzoeken uitvoeren. Eigenlijk zijn axolotls het amfibische equivalent van de fruitvlieg en de laboratoriumrat.’
Eigenaardig genoom
Tot nog toe liep het genetisch onderzoek naar regeneratie bij axolotls steeds tegen een muur. De exacte functie van deze genen is namelijk enorm moeilijk te bepalen. Dat komt omdat het genoom – de complete genetische samenstelling – van een axolotl immens groot is. Het bestaat uit zo’n 32 miljard basenparen. Het menselijk genoom heeft er tien keer minder.
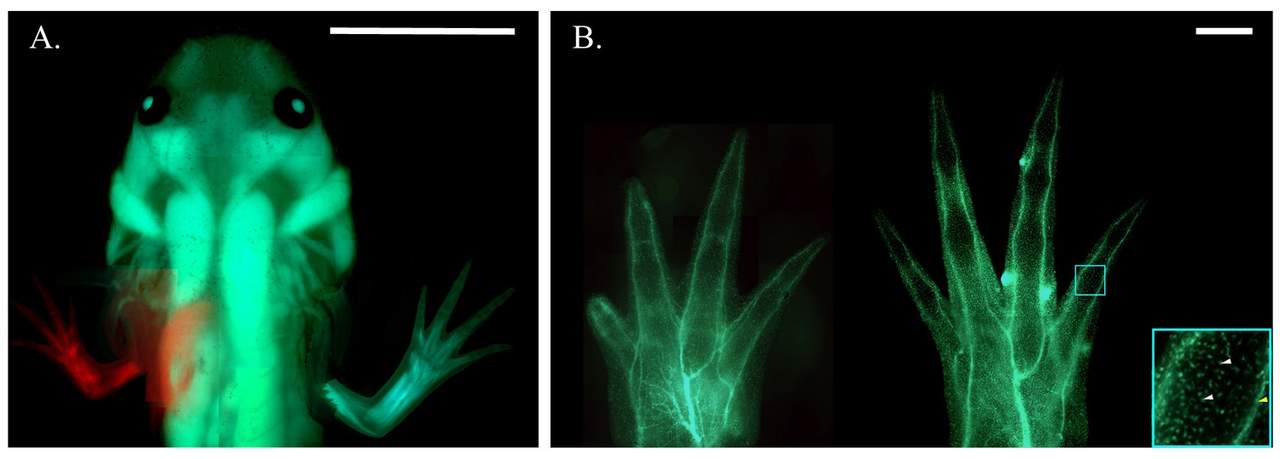
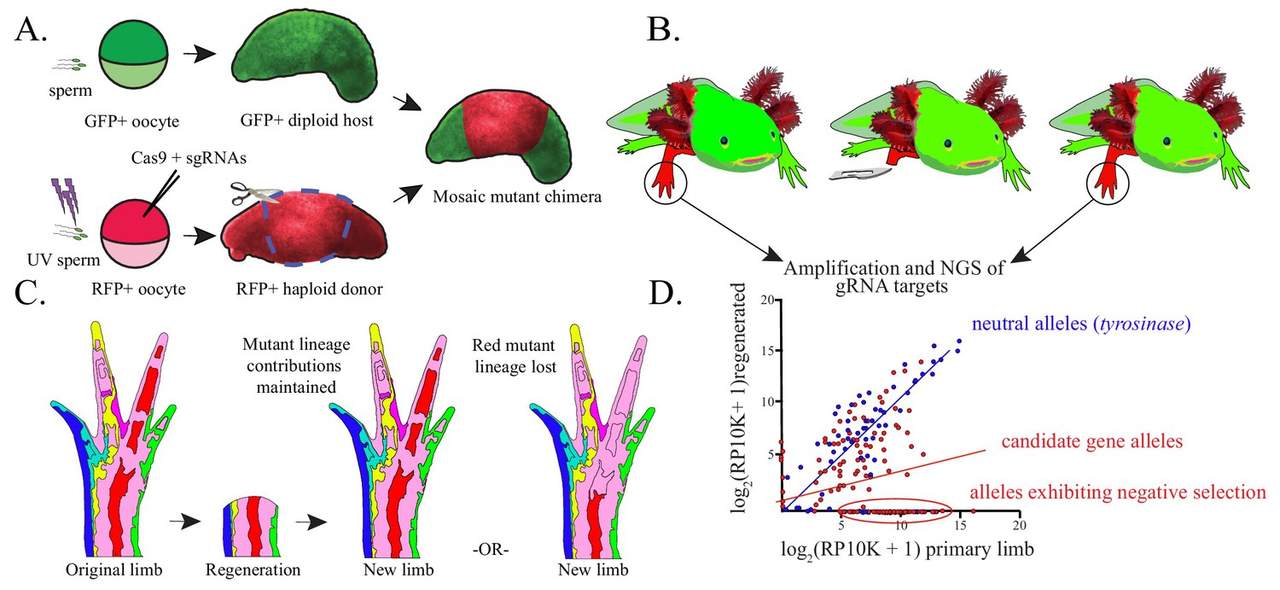
Recent deden moleculair bioloog Grant Parker Flowers en zijn collega’s aan de University of Yale wel een belangwekkende vondst. Ze deden een beroep op genbewerking en merkers om regeneratiegenen op te sporen. Dat deden ze bij haploïde axolotls. Bij zulke soorten is er van elk chromosoom maar één exemplaar aanwezig. Het laat toe om het effect van een uitgeschakeld gen beter op te merken. Flowers en zijn team identificeerden twee genen die voor een gedeeltelijke regeneratie van de staart van een axolotl zorgen. Die twee genen, schrijft hij, zijn voor de goede orde niet de enige die voor regeneratie instaan.
Ontwikkelingsbioloog Eve Seuntjens (KU Leuven), die niet bij het onderzoek betrokken was, toont zich matig enthousiast. Volgens haar hebben de twee geïdentificeerde genen een minimaal effect. ‘De onderzoekers schakelden de genen uit via CRISPR-Cas om het effect op de regeneratie waar te nemen. Dat effect was niet zo groot. De vorm van de staart was nog dezelfde en er groeide zelfs nog een ruggenmergstructuurtje in. De staart was wel een klein beetje korter dan normaal. Als iets essentieel is voor regeneratie verwacht je dat er helemaal niets terug groeit.’
Toch vormt dit onderzoek een belangrijke stap. ‘De wetenschappers vonden een nieuw model voor de axolotl waarmee ze aan de slag kunnen’, vervolgt Seuntjens. ‘Axolotls hebben een complex genoom, en zij zijn erin geslaagd om dat te omzeilen door met haploïde exemplaren te werken. Via deze techniek kunnen er nieuwe genen worden ontdekt, die belangrijker zijn voor regeneratie.’
Menselijke regeneratie
Aangezien mensen vergelijkbare genen hebben, hopen Flowers en zijn collega’s die in de toekomst te activeren, zodat ook de vaardigheid inzetbaar wordt voor mensen. ‘De onderzoekers vonden katalase en fetuin-b, twee eiwitten die wij ook bezitten’, zegt Seuntjens. ‘Toch kunnen we onze armen en benen niet regenereren, gewoon de aanwezigheid van een gen en het gecodeerde eiwit is dus niet goed genoeg. De nodige eiwitten moeten op de juiste plaats en het juiste tijdstip aanwezig zijn. Dat moet nog verder onderzocht worden.’
Seuntjens benadrukt dat opvolgstudies bij zoogdieren belangrijk zijn. ‘De gevonden genen moeten voor onderzoek geactiveerd worden in een dier dat niet kan regenereren. De onderzoekers moeten kijken wat er gebeurt als de genen geactiveerd worden na de amputatie van bijvoorbeeld een muizenpootje. Zal die muis een nieuwe poot aanmaken of niet? Is het activeren van die genen voldoende of moeten ook andere systemen veranderen?’
‘Beschadigd ruggenmerg moet in de toekomst door regeneratie te herstellen zijn’
Seuntjens is er zeker van dat de mens ooit zal kunnen regenereren. Alleen blijft het vooralsnog onduidelijk wanneer dat zal zijn. ‘Het gaat dan wel niet om hele ledematen, daar bestaan al andere oplossingen voor, zoals bionische armen en benen. Bij menselijke regeneratie denk je het best aan het centraal zenuwstelsel, daar wordt meer onderzoek naar gedaan. Wanneer iemand een ongeluk heeft en het ruggenmerg wordt geraakt, kan dit in de toekomst hopelijk door regeneratie herstellen. Het gaat dus niet om het teruggroeien van hele organen en structuren, maar eerder om de axonale banen in de cellen.’ Via axonale banen wordt informatie overgedragen in ons zenuwstelsel.
Van Damme geeft nog mee dat onderzoekers eerst helemaal moeten begrijpen waarom het regeneratieve vermogen van sommige dieren een leven lang actief blijft. ‘Bij veel diersoorten is dat alleen vroeg in het leven aanwezig, en daarna niet meer. In de zoektocht naar antwoorden zijn studies op, bijvoorbeeld, de axolotl zeker nuttig. Als zou blijken dat de verschillen tussen soorten en levensstadia relatief eenvoudig zijn, dan zit daar zeker toekomst in, ook voor de mens.’




