Bij borstkanker verwijdert de chirurg de lymfeklieren met risico op uitzaaiingen. Ik maak en test nanokristallen die de juiste klieren sneller en beter in beeld brengen. Zonder radioactiviteit, zonder dure scanner en zonder risico op een blauw verkleurde borst.
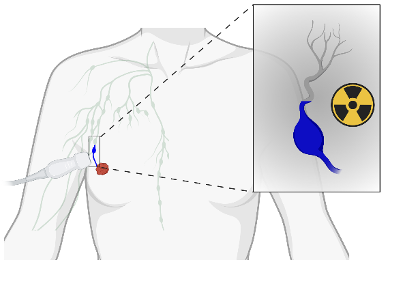
“U heeft borstkanker.” Het is een diagnose die jaarlijks hard binnenkomt voor meer dan 2 miljoen nieuwe patiënten wereldwijd. Tijdens een operatie verwijdert de chirurg de tumor samen met de schildwachtklier, dit is de eerste klier die kankercellen kunnen bereiken. De status van de schildwachtklier, bevat ze kankercellen of niet, bepaalt mee of nabehandelingen zoals chemotherapie en/of radiotherapie nodig zijn. Essentieel dus om de juiste klier te vinden, maar niet zo evident als je weet dat er tientallen klieren in onze oksel zitten. De huidige manier om de schildwachtklier te vinden is door een radioactieve contraststof onderhuids te injecteren, soms gevolgd door een blauwe kleurstof om de chirurg visueel te ondersteunen. Ons lichaam voert deze stoffen af langs dezelfde route die kankercellen nemen en ze bereiken zo de schildwachtklier. Een SPECT scan geeft de algemene klierlocatie weer en tijdens de operatie zoekt de chirurg de schildwachtklier via een draagbaar toestel dat radioactiviteit meet. De bestaande aanpak werkt goed, maar gaat gepaard met een hoop nadelen: dure en trage beeldvorming via SPECT, beperkte beschikbaarheid in ontwikkelingslanden, langdurige blauwe verkleuring van de borst, en blootstelling aan radioactiviteit.
Ik ontwikkelde samen met chirurgen en radiologen een nieuwe contraststof, gemaakt van nanokristallen, die de schildwachtklier voor en tijdens de operatie in beeld kan brengen met respectievelijk CT en fluorescentie. Dit zijn beeldvormingstechnieken die goedkoper, toegankelijker, sneller en nauwkeuriger kunnen werken dan de huidige werkwijze.
Een jasje voor nanokristallen
Het hoofdonderdeel van mijn contraststof zijn nanokristallen. Per definitie zijn nanokristallen tussen één en honderd nanometer groot, groter dan een suikermolecule en kleiner dan bijvoorbeeld het coronavirus. Deze kristallen de juiste grootte geven is essentieel voor detectie van de schildwachtklier, want de kristalgrootte bepaalt hoe snel ze naar de klier worden afgevoerd na injectie. 10 nanometer is voor mijn nanokristallen ideaal, groot genoeg om de juiste klier in beeld te brengen, klein genoeg om het lichaam via de nieren te verlaten.
De nanokristallen maken beeldvorming van de schildwachtklier voor de operatie met CT mogelijk. Normaal zijn klieren moeilijk te onderscheiden van elkaar op CT, een contraststof dat zich in de klier bevindt maakt deze tijdelijk beter zichtbaar op de scan. Quasi ieder ziekenhuis heeft ook een CT scanner beschikbaar, in tegenstelling tot SPECT. Echter, om de nanokristallen te gebruiken in ons bloed en lymfesysteem moeten we ze eerst bekleden met een specifiek jasje van moleculen.

Een naakt nanokristal is niet oplosbaar. Met het juiste jasje aan verandert hun gedrag. Ze worden oplosbaar in een vloeistof, water in ons geval, omdat het jasje stabiliteit geeft. Door de interacties van verschillende types moleculen met de nanokristallen te bestuderen, kon ik zelf het perfecte high-tech jasje ontwikkelen in mijn labo. De moleculen van mijn jasje zijn gebaseerd op polyethyleenglycol: een wateroplosbare keten die proteïnen afstoot.
Het jasje dat ik maakte speelt nog een tweede rol, ik gaf enkele polyethyleenglycol moleculen een ander uiteinde: een infrarood fluorofoor. Deze fluorofoor zorgt ervoor dat mijn contraststof ook infrarood licht kan uitzenden tijdens de operatie. Dit licht penetreert millimeters tot centimeters doorheen weefsel en huid, maar is onzichtbaar voor onze ogen. Het verstoort dus het werkoppervlak van de chirurg niet, in tegenstelling tot de blauwe kleurstof, en geeft ook meer informatie dan de radioactieve contraststof. De combinatie van de nanokristallen en hun jasje samen geeft dus alle info die nodig is om op jacht te gaan naar de schildwachtklier.
De muis als model
Maar… kunnen de nanokristallen nu ook in de praktijk schildwachtklieren identificeren? Het enige antwoord hierop is om over te gaan naar een studie op proefdieren, muisjes in mijn geval. Deze studies zijn allemaal zeer strikt gereguleerd, en terecht ook.

Tijdens mijn experimenten injecteerde ik een oplossing van nanokristallen onderhuids bij mijn muisjes. Door ze op verschillende tijdstippen in de scanners te plaatsen kon ik de natuurlijke afvoer van de nanokristallen volgen in de tijd.
Nanokristallen bieden unieke voordelen tegenover de huidige werkwijze in de kliniek
Wat ik hoopte en verwachtte te zien op de beelden, bleek ook effectief het geval te zijn: de schildwachtklier kon selectief in beeld gebracht worden met zowel CT als met fluorescentie! Onze data toonde aan dat de nanokristallen unieke voordelen bieden tegenover de huidige werkwijze in de kliniek. De nanokristallen vergen slechts één injectie en creëren een procedure die toegankelijker is, meer flexibiliteit geeft, en óók nog eens de klier accurater in beeld brengt dan de huidige methodes. Al deze voordelen zouden een sterke win-win situatie creëren voor zowel de patiënt als de artsen.
Op naar patiënten?
De contraststof zit nu nog in de onderzoeksfase en komende herfst werken we naar een kleine wereldprimeur toe, de contraststof voor de eerste keer ooit testen op een groot proefdier: varkens. Varkens leunen al veel dichter bij de mens aan, ze zullen ons onder meer leren wat de relevante dosissen zijn om aan beeldvorming te doen en wanneer we een patiënt bijvoorbeeld zouden moeten scannen na injectie.
De huidige schildwachtklierprocedure is al meer dan 20 jaar de standaard in ziekenhuizen. Mijn nanokristallen zouden hier eindelijk verbetering in kunnen brengen, niet enkel bij borstkanker, maar ook andere kankers zoals melanoom en hoofd- en halskanker. Maar morgen de eerste patiënt injecteren, dat doen we nog net niet. In nauw overleg met overheidsinstanties voeren we nu diepgaande experimenten uit die de veiligheid van de nanokristallen verder evalueren. Hoe reageert het immuunsysteem? Belasten ze de lever of nieren niet? Als we die vragen, en meer, positief kunnen beantwoorden dan kunnen we streven naar ons ultieme doel: in 2029 de eerste mens injecteren!
Loren Deblock dingt mee naar de Vlaamse PhD Cup 2024. Ontdek meer over dit onderzoek op www.phdcup.be.




