Over de mechanismen achter de zenuw- en spieraandoening ALS is nog maar weinig bekend. In nieuw onderzoek zijn wetenschappers erin geslaagd de schade die de ziekte aanricht in menselijke cellen en proefdieren te beperken.
Amyotrofe laterale sclerose of ALS is een slopende en fatale ziekte die zenuwcellen in de hersenen en het ruggenmerg aantast. Dat bemoeilijkt de communicatie tussen zenuwcellen en spieren waardoor de spieren verzwakken tot zelfs ademen niet meer lukt. Met wat geluk kan medicatie het ziekteproces een paar maanden vertragen, maar de ziekte genezen lukt nog niet.
Over het onstaan van ALS heerst nog onduidelijkheid. Soms is de ziekte erfelijk en wordt een gen dat de ziekte kan veroorzaken doorgegeven van ouder op kind. In de meeste gevallen, ongeveer 90 procent, gaat het om de sporadische vorm waarbij de ziekte bijvoorbeeld ontstaat door een toevallige mutatie van een gen. Een mutatie op het C9orf72 gen is verantwoordelijk voor ruim 30% van de erfelijke en 5% van de sporadische gevallen van ALS en is daarmee de belangrijste genetische oorzaak.
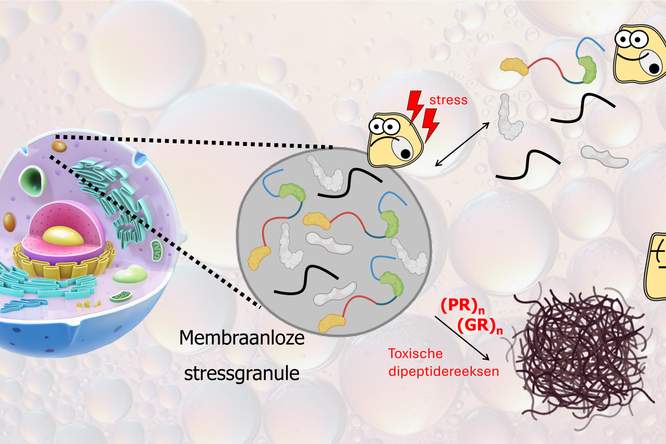
De mutatie van het C9 gen zorgt voor de productie van atypische eiwitten. Die eiwitten kunnen zich in een zenuwcel hechten aan het RNA, dat onder andere instructies van het DNA doorgeeft aan de cellen. Doordat de atypische eiwitten het RNA vasthouden en een soort propje vormen, kan het RNA zijn normale rol in de cel niet meer uitvoeren. Dat kan leiden tot het aftakelen en afsterven van de zenuwcel.
Giftige eiwitpropjes
Onderzoekers van de universiteit van Barcelona ontdekten1 dat poly-GR, een van de atypische eiwitten die ontstaan door een C9-mutatie, zich hecht aan een specifiek stukje RNA. Door dat kleine stukje RNA exact na te maken, probeerden de wetenschappers het eiwit poly-GR te misleiden en te verhinderen dat het aan het echte RNA zou gaan kleven. Op die manier zou het stukje nep-RNA kunnen voorkomen dat de cel aangetast wordt en afsterft.
Voor hun onderzoek bestudeerden de wetenschappers fruitvliegjes en menselijke zenuwcellen in het lab. Drie maanden lang brachten ze maandelijks nep-RNA aan in de menselijke cellen. De toediening van nep-RNA halveerde het aantal cellen met giftige poly-GR propjes. In cellen die toch giftige eiwitpropjes bevatten, stierven een kwart minder zenuwcellen af. Een stukje controle-RNA, dat een voor poly-GR minder aantrekkelijk deeltje RNA bevatte, had daarentegen amper effect.
‘Het is een heel innovatief en methodologisch sterk onderzoek dat hun bevindingen bevestigt in fruitvliegjes en in vitro menselijke zenuwcellen’, zegt Christine Germeys. Ze is neurowetenschapper aan het VIB-KUL Center for brain and disease en was niet betrokken bij dit onderzoek. ‘Fruitvliegjes zijn een mooie aanvulling op de analyse van menselijke cellen in dit onderzoek. Ze hebben een verrassend gelijkaardige genetische samenstelling: voor 75% van de menselijke genen bestaat er een fruitvlieg-variant. Daardoor kan het effect van de behandeling bekeken worden in een levend organisme dat uit meerdere celtypes bestaat.’ Toch legt dit onderzoek slechts een klein stukje van de puzzel. ‘Het gaat hier over één atypisch eiwit, poly-GR, terwijl er nog vier andere zijn waarvan zeker één ook sterk bindt aan RNA. Bovendien zijn er ook nog andere mogelijke mechanismen’, merkt Germeys op. Toch zijn de resultaten goed nieuws voor de wetenschap en het onderzoek naar ALS. ‘Ook andere genen kunnen een rol spelen in het onstaan van ALS. Een techniek als deze kan daar misschien ook effect hebben, al zal aan een concrete behandeling nog een lang en complex proces vooraf gaan. Maar hoe meer de wetenschap achterhaalt over de ziekte, hoe dichter we bij een behandeling komen,’ klinkt het nog.
Dit onderzoek werpt een licht op het mechanisme achter ALS, al zijn de inzichten ook belangrijk voor frontotemporale dementie. In het ontstaan van die ziekte speelt een mutatie op het gen C9 namelijk ook een rol. De resultaten uit dit onderzoek zijn dus relevant voor alle zogenoemgde “C9-patiënten” en niet zuiver voor mensen met ALS.
Een doorbraak in onderzoek betekent niet hetzelfde als een doorbraak in de behandeling. De bevindingen zoals die uit het onderzoek hierboven besproken, kunnen de basis vormen voor een nieuwe therapie, maar het ontwikkelingstraject neemt nog jaren in beslag.