William G. Kaelin Jr, Sir Peter J. Ratcliffe en Gregg L. Semenza delen de Nobelprijs Geneeskunde van dit jaar. Samen ontdekten ze hoe cellen weten hoeveel zuurstof er beschikbaar is en hoe ze zich daaraan moeten aanpassen.
Het fundamentele belang van zuurstof of O2 is al eeuwen bekend. Maar hoe cellen en weefsels zich aanpassen aan veranderingen in de hoeveelheid beschikbare zuurstof, bleef lange tijd een raadsel. Amerikaanse wetenschappers William Kaelin en Gregg Semenza en Brits wetenschapper Peter Ratcliffe identificeerden het moleculaire mechanisme dat schuilgaat achter dit zeer essentiële aanpassingsproces.
Zuurstof is essentieel voor het leven van dieren. Het wordt gebruikt door mitochondriën die in vrijwel alle dierlijke cellen zitten om voedsel om te zetten in bruikbare energie.
In de loop van de evolutie ontwikkelden zich mechanismen om voldoende zuurstof naar weefsels en cellen te voorzien. De halsslagader bijvoorbeeld bevat gespecialiseerde cellen die het zuurstofniveau van het bloed meten. Deze zuurstofmeting regelt de snelheid van onze ademhaling.
Dankzij het baanbrekende werk weten we veel meer over hoe verschillende zuurstofniveaus fundamentele fysiologische processen aansturen
Een andere fysiologische aanpassing aan zuurstoftekort of hypoxie is de stijging van het hormoon erytropoëtine (EPO), wat leidt tot een verhoogde productie van rode bloedcellen. Het belang daarvan was al bekend aan het begin van de twintigste eeuw, maar hoe dit proces precies werd aangestuurd door zuurstof, bleef een mysterie.
Kaelin, Ratcliffe en Semenza ontrafelden dit mechanisme. Dankzij hun baanbrekende werk weten we veel meer over hoe verschillende zuurstofniveaus fundamentele fysiologische processen aansturen. We weten nu dat cellen hun metabolisme kunnen aanpassen aan lage zuurstofgehaltes, wat bijvoorbeeld gebeurt in onze spieren tijdens een intensieve training. Het mechanisme is ook essentieel tijdens de ontwikkeling van de foetus voor de normale vorming van bloedvaten en de ontwikkeling van de placenta. En tumoren gebruiken het mechanisme om de vorming van bloedvaten te stimuleren en om het metabolisme ertoe aan te zetten de groei en verspreiding van kankercellen te bevorderen.
De ontdekkingen hebben bijgedragen aan de ontwikkeling van nieuwe behandelingen om ziektes zoals bloedarmoede en kanker te bestrijden.
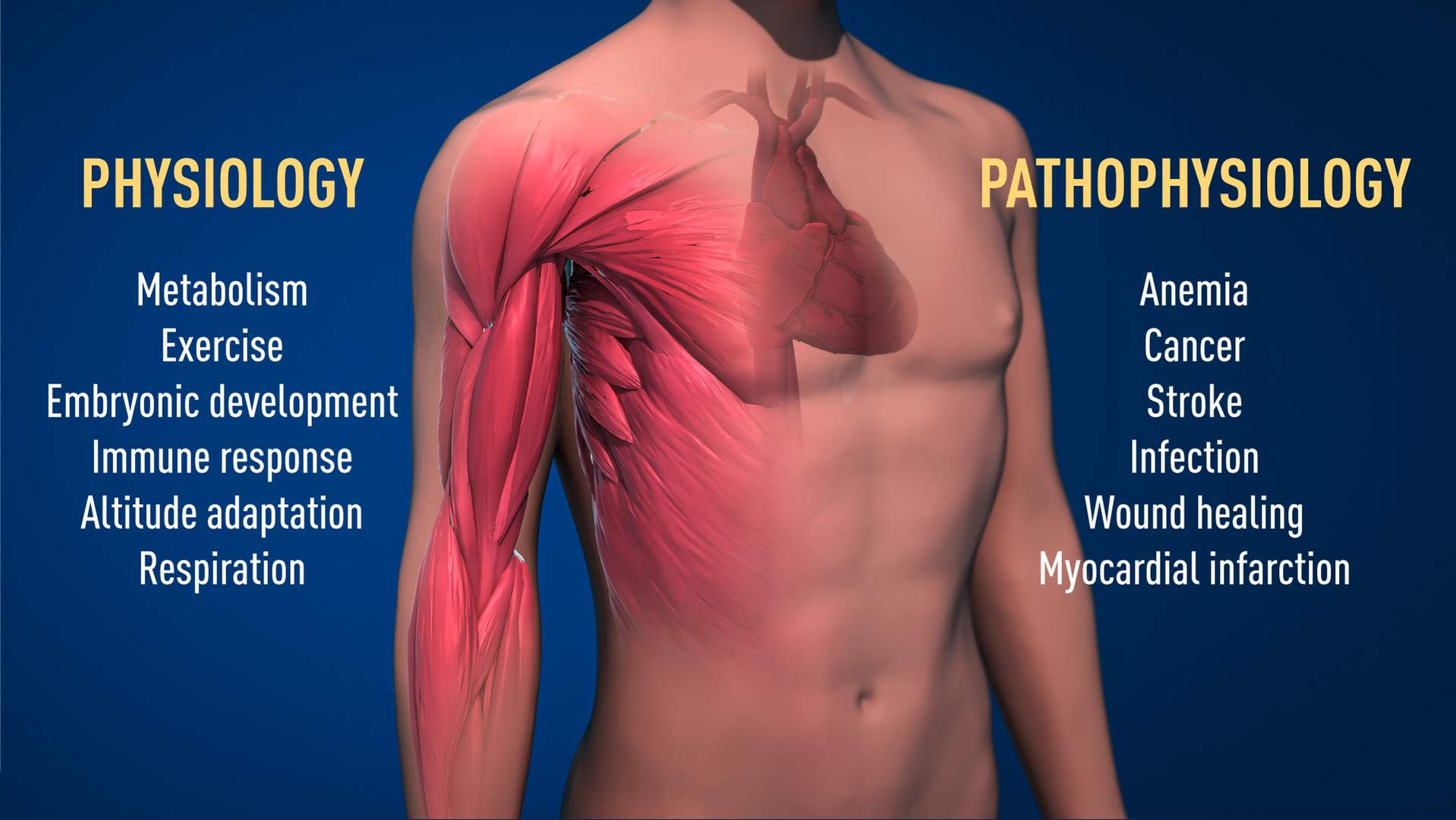
Illustratie boven: Het ontdekte mechanisme is van fundamenteel belang in de fysiologie, bijvoorbeeld voor ons vermogen om ons aan te passen aan lichaamsbeweging. Ook tal van pathologische processen worden erdoor beïnvloed. De ontdekkingen kunnen leiden tot nieuwe geneesmiddelen voor de behandeling van onder andere bloedarmoede en kanker.
Wat ontdekten ze nu precies?
Semenza bestudeerde het EPO-gen en hoe het door verschillende zuurstofniveaus wordt beïnvloed. Hij ontdekte bij gemodificeerde muizen specifieke DNA-segmenten rond het EPO-gen die een rol spelen bij de respons op zuurstoftekort. Ook Ratcliffe bestudeerde de zuurstofafhankelijke werking van het EPO-gen. Beiden ontdekten dat het mechanisme aanwezig is in vrijwel alle weefsels en niet alleen in de niercellen waar EPO wordt geproduceerd.
Semenza wilde de cellulaire componenten identificeren die deze reactie veroorzaken. In gekweekte levercellen ontdekte hij een eiwitcomplex dat zich op een zuurstofafhankelijke manier bindt aan het geïdentificeerde DNA-segment. Hij noemde dit de hypoxie-induceerbare factor (HIF). Later ontdekte hij dat HIF bestaat uit twee verschillende DNA-bindende eiwitten, HIF-1αen ARNT. Wanneer het zuurstofniveau hoog is, bevatten cellen zeer weinig HIF-1α. Wanneer de zuurstofniveaus laag zijn, neemt de hoeveelheid HIF-la toe.
Verschillende onderzoeksgroepen toonden vervolgens aan dat HIF-1α, dat normaal snel wordt afgebroken, wordt beschermd tegen afbraak bij zuurstoftekort.Bij normale zuurstofniveaus wordt een klein peptide, ubiquitine, aan het HIF-la-eiwit toegevoegd. Ubiquitine fungeert als een label voor eiwitten die bestemd zijn voor afbraak in het proteasoom. Hoe ubiquitine op een zuurstofafhankelijke manier bindt aan HIF-1αbleef onduidelijk.
Het antwoord kwam uit onverwachte hoek. Rond dezelfde tijd dat Semenza en Ratcliffe de regulatie van het EPO-gen aan het onderzoeken waren, onderzocht kankeronderzoeker Kaelin een erfelijk syndroom, de ziekte van Hippel-Lindau. Deze genetische ziekte leidt tot een dramatisch verhoogd risico op bepaalde kankers in families met erfelijke VHL-mutaties. Kaelin toonde aan dat het VHL-gen codeert voor een eiwit dat het ontstaan van kanker voorkomt.
Kaelin toonde ook aan dat kankercellen die een functioneel VHL-gen missen, abnormaal hoge niveaus van door zuurstoftekort gereguleerde genen tot expressie brengen. Maar ook dat toen het VHL-gen opnieuw in kankercellen werd geïntroduceerd, de normale niveaus werden hersteld. Dit was een belangrijke aanwijzing die aantoonde dat VHL betrokken was bij het beheersen van de reacties op zuurstoftekort.
Later ontdekten Kaelin en Ratcliffe nog dat onder normale zuurstofniveaus hydroxylgroepen worden toegevoegd op twee specifieke posities in HIF-1α (zie illustratie hieronder). Deze eiwitmodificatie, prolylhydroxylering genoemd, stelt VHL in staat om HIF-1α te herkennen en eraan te binden. Het verklaart hoe normale zuurstofniveaus snelle HIF-1α-afbraak regelen met behulp van zuurstofgevoelige enzymen.
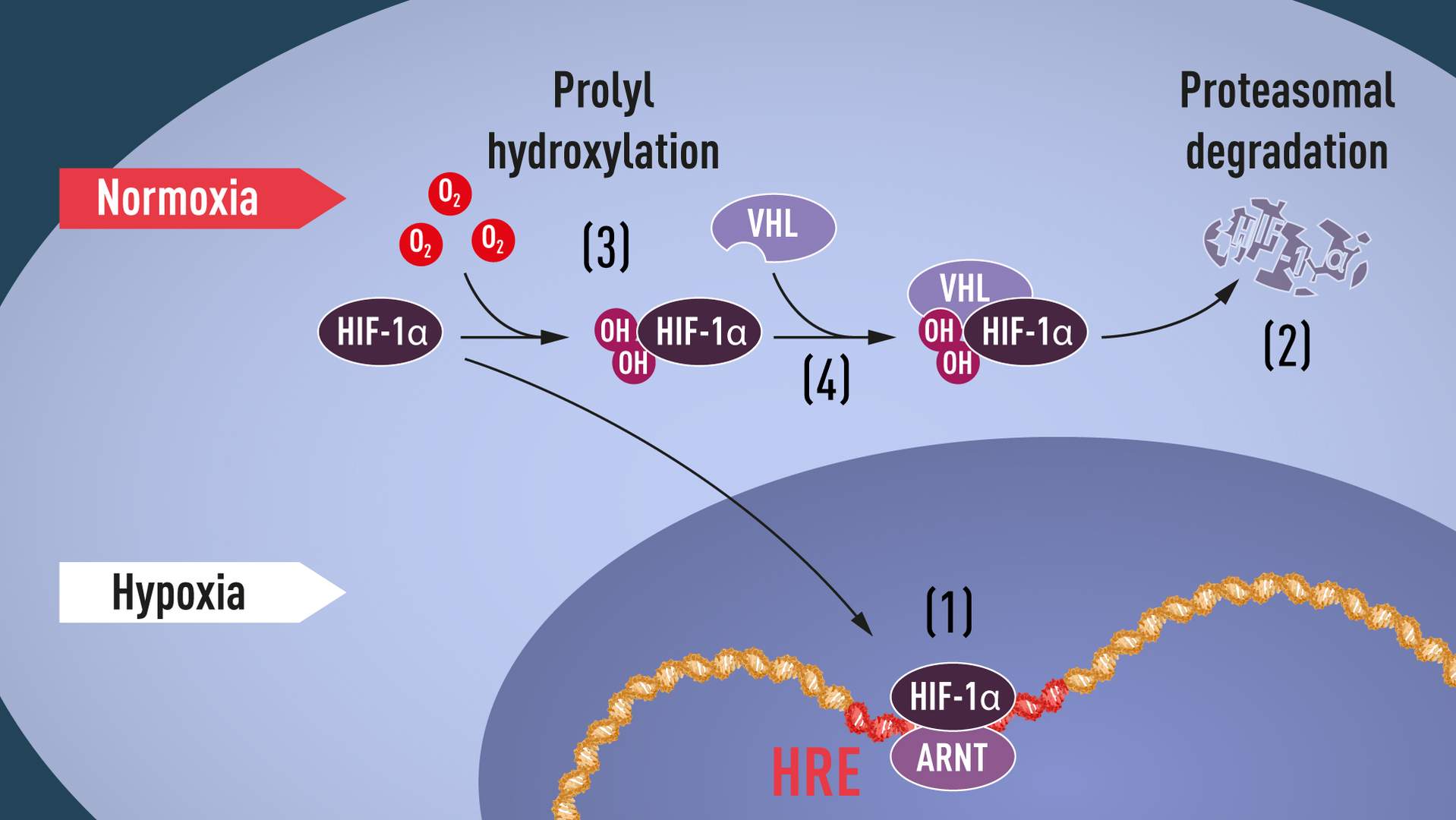
Illustratie boven: Wanneer zuurstofniveaus laag zijn (hypoxie), wordt HIF-1a beschermd tegen afbraak en hoopt het zich op in de kern, waar het associeert met ARNT en bindt aan specifieke DNA-sequenties (HRE) in door hypoxie gereguleerde genen (1). Bij normale zuurstofniveaus wordt HIF-la snel afgebroken door het proteasoom (2). Zuurstof regelt het afbraakproces door de toevoeging van hydroxylgroepen (OH) aan HIF-1α (3). Het VHL-eiwit kan vervolgens een complex met HIF-la herkennen en vormen, wat leidt tot zijn afbraak op een zuurstofafhankelijke manier (4).




